0 引言
在近年的研究中,Sasaki等[3]在日本富山县东部地热区,采用地热井水中Na/K温标,估算了该深部温度分布范围。Barberi等[4]在加勒比板块的两个高温地热田区,开展了土壤气二氧化碳测量,研究认为地表土壤二氧化碳气体高值异常对于深部裂隙型热储具有较好的反映能力。然而在勘探开发过程中,由于地热水开采污染、现代外来冲积物质干扰以及部分地热田良好的封盖条件,导致与地热田有关的元素向地表扩散的强度受到一定抑制,不能达到可探测浓度。随着微生物勘探技术的发展,微生物逐步开始在能源勘探领域展开应用[5⇓-7]。这项技术也引起中国资源勘探者的重视,从20世纪90年代中至今已在大庆油田、准噶尔盆地、松辽盆地、柴达木盆地、塔里木盆地和四川盆地等勘探区块开展了应用研究,取得了良好的验证与预测效果[8⇓⇓-11]。在过去的60年间,国内外学者对指示菌的形态与分类、生理特征、酶学特性、代谢途径、生态分布以及环境因素对微生物生长发育的影响等开展了大量的基础性研究[12⇓-14]。同样在地热资源的勘探发展中,研究者发现由于热泉或地热田的存在,导致了该处环境下生长的微生物种群结构与其他区域具有显著的差异,这些特殊的微生物种群可以作为地热存在的标志[15⇓⇓⇓⇓⇓⇓⇓-23]。已有文献报道,研究人员成功分离出一株高温碱性蛋白酶产生菌株H-1,经初步鉴定为芽孢杆菌(Bacillus),该菌株只在温泉出露区域检测到,或可用作地热标志微生物[24-25]。在实际地热的勘探开发中,微生物的应用尚未见报道。而对于复杂地形类型中如隆起山地型地热田,其上方是否也有特殊的微生物生长,尚不得而知。
本研究通过高通量测序技术对巢湖半汤温泉以及含山昭关温泉地热田和周围非地热区域的微生物群落多样性进行研究,考察隆起山地型地热田内的微生物群落特征,结合酸解烃、顶空气、土壤蚀变碳酸盐和微量元素检测,分析了研究区的土壤地球化学特征,以期能够发现各项指标与地热田之间的相关性,寻找潜在的特征性地热微生物,为微生物技术应用于地热勘探提供理论和实践依据。
1 工区地质概况
半汤温泉与昭关温泉都位于滁河断裂带,滁河断裂发育在扬子板块内部,郯庐大断裂东侧,在空间上属郯庐大断裂的重要组成部分[26]。滁河断裂总体走向NE50°~60°,断裂主体部分在安徽境内,长约170 km,宽约5 km,自北东向南西经江苏省浦口镇、亭子山,安徽省和县香泉、石杨及含山县昭关、清溪北、巢湖市半汤, 过巢湖南延至庐江县郯庐断裂带消失[27]。半汤温泉与昭关温泉处在滁河断裂带南端,构造上处于下扬子台坳的北部,位于汤山背斜轴部断裂构造发育带,分布在丘陵与冲积平原的交接地带,有30多处泉点分布在受滁河断裂控制的伴生断层上[28]。昭关温泉受NE向滁河断裂带的控制,出露于该断裂东南一侧的寒武系观音台组白云岩及白云质灰岩NW向次级断裂构造破碎带中,成群出露[29]。半汤地热田位于汤山背斜南西倾伏端,背斜核部由震旦系、寒武系、奥陶系碳酸盐岩类地层组成,南、东、西(背斜两翼)三面则分布着志留系砂质页岩、泥岩等极弱含水层,自然形成一个封闭式储水构造。昭关地热田出露地层岩性为震旦系、寒武系碳酸盐岩,志留系、白垩系砂岩、泥岩以及第四系黏土[30]。
2 数据采集及实验方法
2.1 样品采集
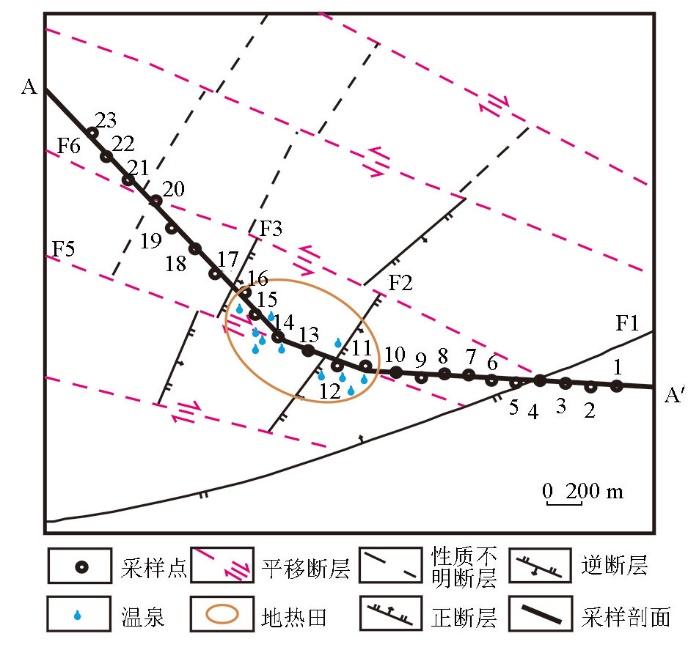
将半汤温泉作为试验区部署一条穿过地热田的地表地球化学剖面(A—A’,图1)。剖面线全长5.2 km,设置采样点间距200 m,共计23个采样点,在本文中分别用1~23表示,其中地热区样品为11、12、13、14、15、16,共计6个,背景区样品为1、2、3、4、5、6、7、8、9、10、17、18、19、20、21、22、23,共计17个。用麻花钻将60 cm深度的土样采集后快速装入已灭菌的密封袋中,低温运输至实验室,-20 ℃保存,以待后续测试研究。此外,为了分析不同来源的地热田微生物群落结构特征差异,Beta多样性分析中加入了与实验室前期采集的含山地区的昭关温泉6个样品的对比,其中Z4、Z5、Z6为地热田上方样品,Z1、Z2、Z3为背景区样品。
图1
图1
半汤地热田地质及化探剖面示意
Fig.1
Geological and geochemical exploration profile of Bantang geothermal field
2.2 样品DNA提取
每个样品称取1 g土壤,用Fast DNA SPIN (MP Biomedicals,Santa Ana,CA)土壤试剂盒提取土壤总DNA,具体操作步骤参考试剂盒说明书。通过微量紫外分光光度计(Nano Drop ND-1000UV)测定DNA浓度和纯度(OD260/OD280和OD260/OD230)。此外,用1.2%的琼脂糖凝胶电泳分离5 μL的DNA用以检测其完整性。
2.3 实验方法
2.3.1 高通量测序
利用通用引物,对提取到的DNA进行扩增细菌16S rRNA基因的V4-V5区基因片段,通用引物分别为515F(5’-GTGCCAGCMGCCGCGG-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT-3’)[31]。为区别不同的样品,用含有特异碱基的序列来标定用于焦磷酸测序的通用引物。PCR反应体系为50 μL,扩增条件为:94 ℃变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共进行30个循环;72 ℃延伸10 min。获得不同样品的扩增产物后,等摩尔混合到一个试管中,通过凝胶回收的方法,纯化PCR产物,并且测定其纯度。高通量测序是运用双末端测序(Paired-End sequencing)的方法实现,由上海昂朴生物科技有限公司在Illumina HiSeq测序平台完成。
将得到的测序结果进行信息学解析,对微生物物种的OTU(Operational Taxonomic Units)进行聚类分析和Beta Diversity分析(Beta多样性),其中包括半汤温泉的16个样品和昭关温泉的6个样品。对不同样品的OTU聚类和注释结果进行综合统计,生成微生物在门水平上和纲水平上的群落结构分布图,这种对每个样品注释到各分类水平上的序列数进行统计的方法,能够更加快捷、全面地了解每个样品的OTU聚类情况和注释情况,并且通过Beta多样性分析,得到半汤温泉和昭关温泉区域样品中独有的种属和共有的种属,生成多元统计分析图,结合微生物群落结构热图,解析半汤温泉及周边环境微生物群落结构特征 [32]。此外,通过统计微生物相对丰度,生成主要类群微生物相对丰度分布图。
2.3.2 酸解烃检测
称取样品50 g至于磨口烧瓶中,进行脱气,抽真空至接近-0.1 MPa,停止抽真空后15 min真空度降低不得超过0.01 MPa。加入50 mL氢氧化钾溶液,置于40 ℃水浴锅中,缓慢滴加盐酸溶液,至不再产生气泡时,停止加酸平衡20 min。使用玻璃注射器抽取脱出气体,以排水集气法注入盛过饱和氯化钠溶液的密封瓶内进行气相色谱分析检测[33]。检测工作由无锡石油地质研究所实验测试中心完成,所用仪器为GC-2010气相色谱仪(日本岛津公司生产,配AOC5000 自动进样器、FID检测器)。
2.3.3 顶空气检测
土壤样品取样时迅速装入300 mL预先加入100 mL过饱和氯化钠溶液的密封瓶中,剩余50 mL空间,立即密封,倒置到达气液固相平衡。震荡30 min,用注射器向密封瓶注入适量过饱和氯化钠溶液,使瓶内为正压。使用玻璃注射器抽取脱出气体,以排水集气法注入盛过饱和氯化钠溶液的密封瓶内进行气相色谱分析检测[34]。检测工作由无锡石油地质研究所实验测试中心完成,所用仪器为安捷伦7890A气相色谱仪和7697顶空自动进样仪(色谱柱PLOT-Q:30 m×0.53 mm×40 μm)。
2.3.4 土壤蚀变碳酸盐检测
称取2 g样品放入500 ℃的氧化炉中,恒温通氧氧化1 h。冷却后将样品放入600 ℃恒温密封分解炉中1 h,分解出的气体接气相色谱进行测定[35]。检测工作由无锡石油地质研究所实验测试中心完成,采用HP5890Ⅱ型色谱仪,由外标法进行定量,使用Wasson KC5色谱柱 (50 m×0.53 mm内径×10 μm),用氦气(纯度为99.999%) 作载气。
2.3.5 微量元素检测
称取50 mg样品置于恒温250 ℃的热释炉中热释6 min,30 s取出捕获器放入热释炉中进行捕获,按照标准曲线测定吸光值[36]。检测工作由无锡石油地质研究所实验测试中心完成,所用仪器为意大利MilestoneDMA-80测汞仪。
2.3.6 土壤气检测
将取样器插入土壤中,通过大气采样器抽取土壤中的气体,接入测氡仪后启动仪器,静置15 min后即可读取观测值;用捕汞管富集形成汞齐,将捕汞管接入测汞仪进行进样分析。检测工作由无锡石油地质研究所实验测试中心完成,所用仪器为意大利MilestoneDMA-80测汞仪以及FD216型测氡仪。
3 实验结果与综合研究
3.1 常规地球化学特征
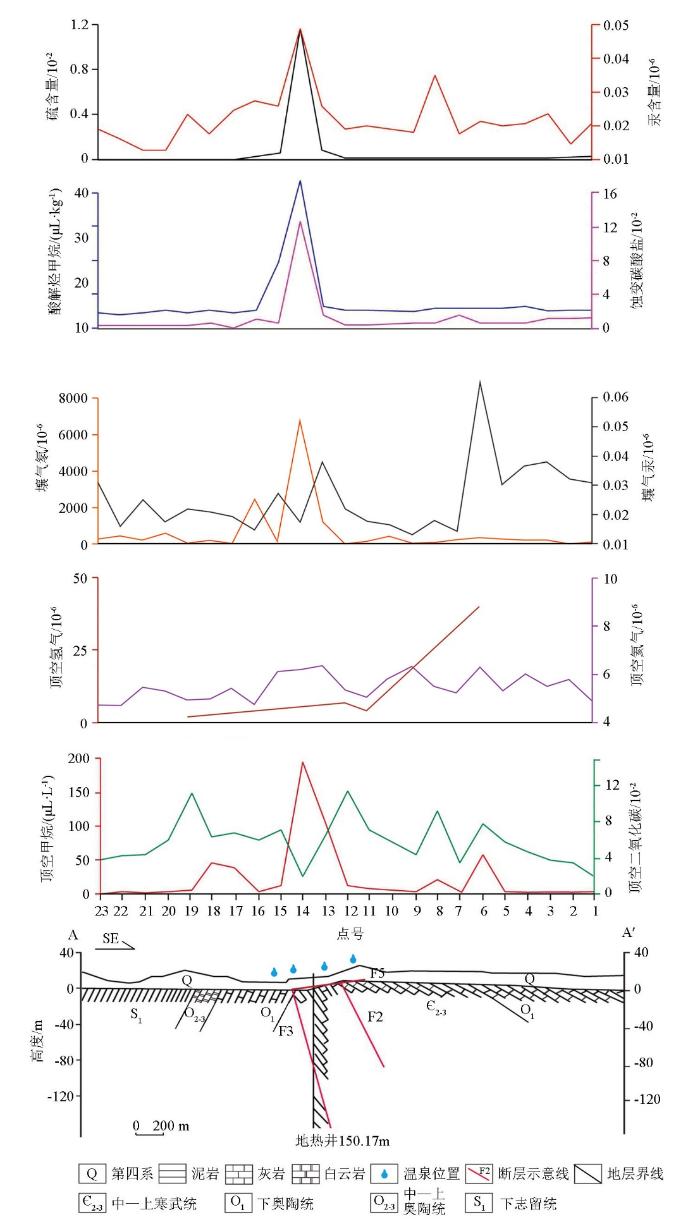
半汤温泉地热田A—A’剖面顶空气(甲烷、二氧化碳、氢气、氦气)、土壤气(汞、氡气)、酸解烃甲烷、蚀变碳酸盐及微量元素S、Hg的浓度分布特征如图2所示。
图2
图2
半汤温泉A-A’剖面上方地球化学指标异常特征
Fig.2
Abnormal characteristics of geochemical indices over A-A’profile in Bantang hot spring
半汤温泉地热田剖面蚀变碳酸盐平均含量为1.71%,最高浓度值为12.50%,最高浓度值主要分布于地热田F3断层与F2断层之间,且在空间分布上受F3、F5断层控制明显,F3、F5断层交汇部位的高浓度碳酸盐显示含有大量HCO3-、Ca2+离子的地下水沿断层上升运移到近地表,沉积碳酸盐。碳酸盐指标在半汤温泉地热田剖面显示了较好的地球化学效应。
微量元素S、Hg的异常均出现在F3断层、F2断层与F5断层交汇部位上,最高值分别达到1.12%和0.48×10-6,不同指标的异常特征表现出了高度一致。
剖面中酸解烃甲烷平均值为7.74 μL/kg,最大值为43.7μL/kg,最大值分布于地热田F3 、F2断层与断层F5交汇部位上。半汤地热田含水岩组岩性主要为粉砂岩、灰岩、白云质灰岩、白云岩等碳酸盐类,水质类型为HCO3-Ca·Mg型、SO4-Ca型,反映存在水—岩相互作用,矿化度达1 948.1 mg/L。当地热田热水通过断层与微裂隙上渗运移到近地表时,因温度的变化部分溶解在热水中的碳酸盐类将沉淀在地表土壤中,泉华的形成就是泉水中大量的矿物质在流出地表时由于温度压力的变化而沉淀出来。地热田研究表明,甲烷也是常见的地热田伴生气体之一,地热田中甲烷通过垂向微渗漏至地表,被地表土壤碳酸盐矿物吸附形成化学吸附态烃类,通过酸解破坏碳酸盐矿物晶格释放出化学吸附的甲烷,可以指示地下热储[37]。
壤气氡在F2、F3断层交汇部位有明显的异常高值,指示地热田区域效果较好。壤气汞在F2、F3交汇部位温泉附近有弱幅度异常,可能由于该部位水系发育,影响了壤气汞的吸附性。
顶空氢气在剖面上多数样点未检出,无法反映剖面上地热地球化学特征。顶空氦气平均浓度为5.43×10-6,接近于大气平均值5.24×10-6。顶空轻烃样品经检测,烃类以甲烷为主,含量占99%以上,超过3/4的样品未检出乙烷及重烃成分,检测样品甲烷平均浓度为24.53 μL/L,最高浓度为196 μL/L,最高浓度点分布于F2、F3断层之间,且在半汤温泉地热田东部也检测到顶空甲烷异常点,甲烷浓度达到57.5 μL /L,可能为F1断层的显示。在半汤温泉地热田F3断层西部有2个化探采样点出现异常,顶空甲烷浓度分别为39.1 μL/L和48.8 μL/L。从半汤温泉地热田顶空甲烷剖面可以看出,顶空甲烷较好地反映了热水最有利部位及断裂的位置。
正常情况大气二氧化碳(CO2)浓度为0.039%,而半汤温泉地热田地表CO2浓度超过0.1%,高达0.115%,是大气的近3倍,呈明显高浓度异常,CO2浓度在地热井东、西两侧呈明显高浓度异常,异常高值分别分布于热田西北部边界F3断层西侧和F2断层东侧,异常空间上呈环绕热泉分布。热泉正上方CO2浓度明显低于热泉边缘,从地热田边界至地热田外围CO2浓度呈降低变化趋势。CO2在半汤温泉地热田剖面显示了很好的地球化学效应。
地球化学分析结果圈定了半汤温泉地热田的大致范围,为研究地热田上方微生物种群和群落结构的指示性提供了依据。通过半汤地热田地表地球化学特征来看,隆起山地型地热田地表地球化学指标主要受断层控制,以破碎带处地球化学异常最为显著。
3.2 微生物地球化学特征
3.2.1 半汤地热区微生物群落结构
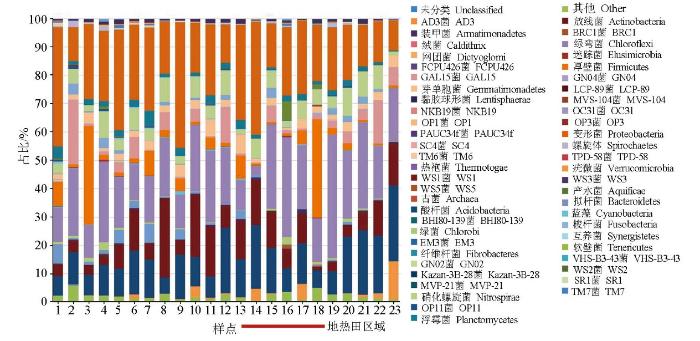
对高通量测序结果的系统发育学分析,所有样品6 507个细菌OTU共划分为22个门(图3),其中优势细菌包括酸杆菌(Acidobacteria)、放线菌(Actinobacteria)、绿弯菌(Chloroflexi)和厚壁菌(Firmicutes)。与同类研究进行比较,董海良等[38]通过高通量测序结合环境条件来综合评价西藏和腾冲中低温温泉微生物群落地理分布特征及控制因素,结果显示中温温泉中适合产水菌门(Aquificae)和泉古菌门(Crenarchaeota),然而低温温泉(22~60 ℃)更适合异常球菌—栖热菌门(Deinococcus-Thermus)、蓝细菌门(Cyanobacteria)和绿弯菌门(Chloroflexi);极端嗜热微生物热脱硫杆菌门(Thermodesulfobacteria)与温度呈正相关,其他几种耐热微生物如异常球菌—栖热菌门(Deinococcus-Thermus)、蓝细菌门(Cyanobacteria)和绿弯菌门(Chloroflexi)与温度均为负相关关系。Guo等[39]研究了青藏高原东部地热带3个典型热场低温—高温温泉的水化学特征和微生物群落组成,结果显示中高温(55~70 ℃)温泉的优势菌为产水菌门(Aquificae)和泉古菌门(Crenarchaeota)。由此可见,前人研究的出露温泉的微生物与本研究地热田上方的微生物还是呈现一定程度的差异,而地热田区域与周边背景区样品微生物物种在门水平上未呈现显著性差异。
图3
图3
地热田及周边样品微生物群落分布(门水平)
Fig.3
Microbial community map of different sources (Phylum level)
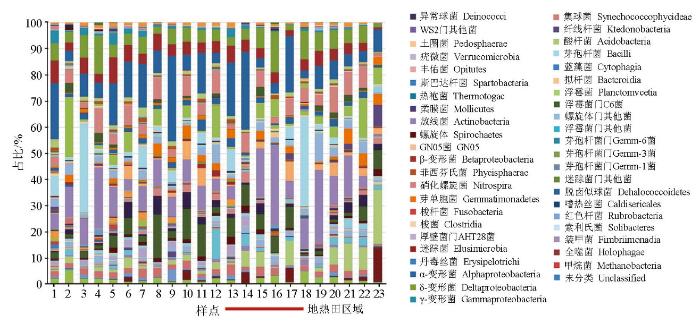
在纲的水平上,地热田地区土壤微生物的序列属66个纲,其中最优势的纲为放线菌(Actinobacteria),其次为酸杆菌(Acidobacteria)和厚壁菌(Firmicutes)(图4)。通过比较,地热田及周边样品也均无显著性差异,表明从大的分类尺度上,地热田的存在以及造成的周围生态环境的变化并没有使总群落发生明显演替,需要对关键种属进行进一步地解析。
图4
图4
地热田及周边样品微生物群落分布(纲水平)
Fig.4
Microbial community map of different sources (Class level)
3.2.2 不同来源地热区微生物群落发育多样性解析
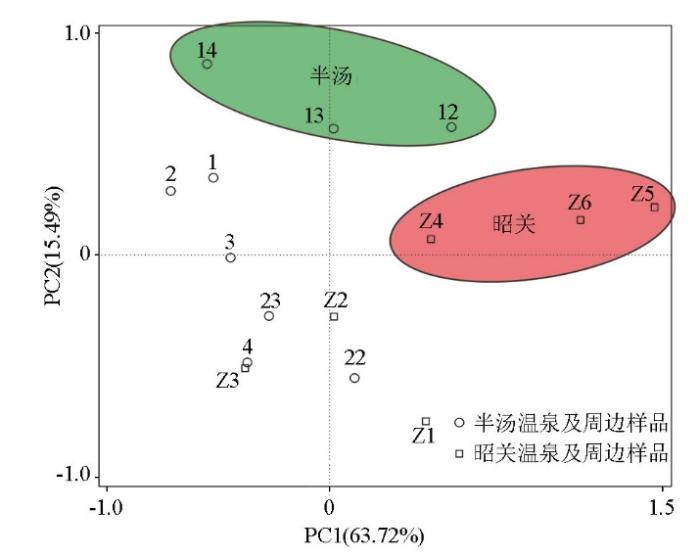
为了进一步厘清隆起山地型地热田上方微生物群落结构特征,将本次采集的半汤样品和已知的昭关样品进行比较,对两个地区样品中微生物物种采用Beta多样性分析(图5)。本研究采用多元统计分析方法得出,半汤区温泉上方的样品12、13、14呈现组内相互聚集,背景区样品较为分散,说明了地热区微生物群落特征较为一致,同时有别于背景区;同样,在昭关区地热区上方样品Z4、Z5、Z6呈现较强的相似性,聚类特征十分明显,而背景样品则较为分散。因此推测通过地热田及其周围环境的长期驯化,经过长期的演替,土壤中的微生物在科水平上形成了独特的群落结构。
图5
图5
不同来源样品微生物群落Beta多样性分析
Fig.5
Beta diversity analysis of microbial community of soil samples from different sources
多元统计分析结合生态学群落组间差异的Metastats算法,发现半汤温泉地热区样品中相对丰度排名前五的微生物相对丰度显著高于对照,按相对丰度排序为芽孢杆菌科(Bacillaceae)、嗜氢菌科(Hydrogenophilaceae)、热脱硫弧菌科(Thermodesulfovibrionaceae)、消化链球菌科(Peptostreptococcaceae)、梭菌科(Clostridiaceae),其中芽胞杆菌科(Bacillaceae)在地热田上方的相对丰度均值约为0.210%,与背景区差值约为0.178%;嗜氢菌科(Hydrogenophilaceae)在地热田上方的相对丰度均值约为0.110%,与背景区差值约为0.108%;热脱硫弧菌科(Thermodesulfovibrionaceae)在地热田上方的相对丰度均值约为0.060%,与背景区差值约为0.057%,这3类菌种在地热田上方与背景区上方的相对丰度均值之间差值较大,可能具有很强的地热资源指示意义(表1)。
表1 半汤地热田微生物相对丰度排列
Table 1
| 排名 | 菌种名称 | 地热田上方 丰度均值/% | 背景区丰 度均值/% | 差值/% |
|---|---|---|---|---|
| 1 | 芽孢杆菌科(Bacillaceae) | 0.210353789 | 0.032049 | 0.178305 |
| 2 | 嗜氢菌科(Hydrogenophilaceae) | 0.110271807 | 0.002218 | 0.108054 |
| 3 | 热脱硫弧菌科(Thermodesulfovibrionaceae) | 0.060291076 | 0.002938 | 0.057353 |
| 4 | 消化链球菌科(Peptostreptococcaceae) | 0.041819903 | 0.000529 | 0.041291 |
| 5 | 梭菌科(Clostridiaceae) | 0.042082563 | 0.002736 | 0.039347 |
| 6 | 动球菌科(Planococcaceae) | 0.02255116 | 0.001332 | 0.021219 |
| 7 | 地杆菌科(Geobacteraceae) | 0.01878669 | 0.005147 | 0.01364 |
| 8 | 类芽孢杆菌科(Paenibacillaceae) | 0.027219813 | 0.017902 | 0.009318 |
| 9 | 黄单胞菌科(Xanthomonadaceae) | 0.015909608 | 0.007594 | 0.008316 |
| 10 | 脱硫叶菌科(Desulfobulbaceae) | 0.005723484 | 0.001101 | 0.004622 |
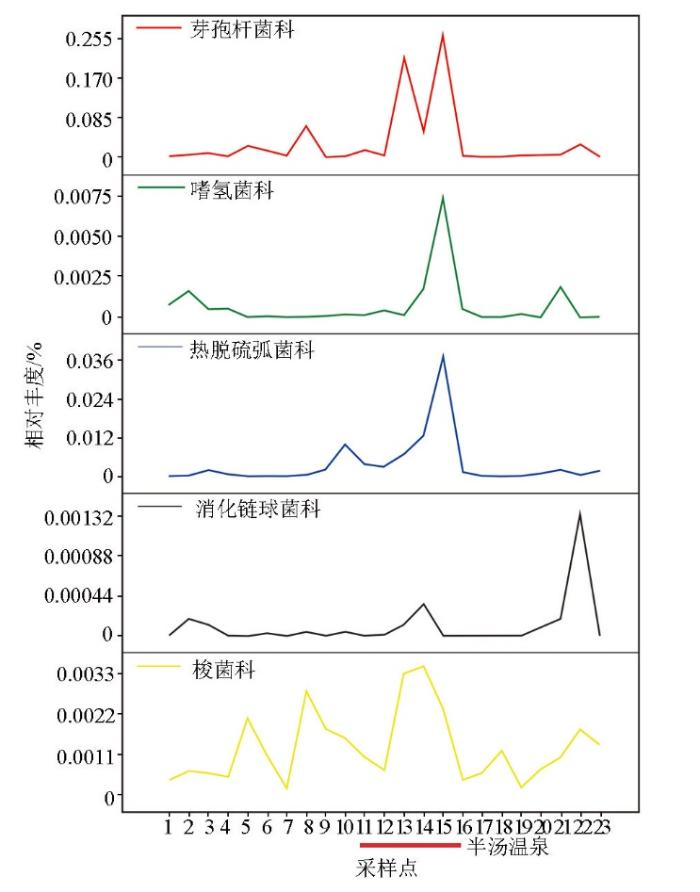
为了探究此类微生物是否具有区别地热区与背景区的作用,将排名前五的微生物相对丰度值与采样剖面点位一一对应。从微生物相对丰度分布来看,芽胞杆菌科(Bacillaceae)、嗜氢菌科(Hydrogenophilaceae)和热脱硫弧菌科(Thermodesulfovibrionaceae)确实属于地热敏感性菌种,并与地热田有着很好的对应关系(图6)。在地热资源地球化学勘探中,可利用这样的对应关系圈定地热田区域,为地热资源勘探提供可靠依据。
图6
图6
半汤地热田剖面地热指示微生物相对丰度分布
Fig.6
Distribution of relative abundances of microorganisms in geothermal indication of Bantang geothermal field
4 结论
本研究在安徽巢湖半汤温泉地热田及周边设计了剖面进行生物地理学研究,以地热田区和背景区的土壤样品作为研究对象,通过高通量测序技术分析地热微生物群落结构,结合不同的地球化学指标,并与同为隆起山地型的昭关地热田进行比较,研究地热田土壤微生物的多样性和土壤地球化学指标,以及该地区微生物与地热田的相关性。
研究结果显示,半汤温泉F2断层、F3断层处顶空甲烷、壤气氡、酸解烃甲烷以及蚀变碳酸盐等化探异常明显,从半汤温泉地热田剖面可以看出,这些指标较好地反映了热水最有利部位及断裂的位置。由于地热田资源造成周围生态环境区别于非地热田生境,因此该地区土壤中微生物群落结构不同于其他生境中的群落结构。从半汤地热田剖面指示微生物相对丰度分布可以看出芽胞杆菌科(Bacillaceae)、嗜氢菌科(Hydrogenophilaceae)和热脱硫弧菌科(Thermodesulfovibrionaceae)与隆起山地型地热田有着很好的对应关系。地热田指示微生物的丰度与地球化学场高值位置响应关系较好,对地热资源的分布具有一定指示作用,但由于不同构造区域微生物群落结构有一定差异,需要后续研究中进一步探究不同构造区域地热田微生物的指示作用。
参考文献
地热勘查中各种技术方法的综合应用
[J].
Comprehensive application of various techniques and methods in geothermal exploration
[J].
我国地热资源勘探技术及其应用
[C]//
Technique and application of geothermal resources exploration in China
[C]//
Geochemical study of hot springs associated with new geothermal exploration in the eastern part of Toyama Prefecture,Japan
[J].DOI:10.1016/j.proeps.2013.03.109 URL [本文引用: 1]
New geochemical investigations in Platanares and Azacualpa geothermal sites (Honduras)
[J].DOI:10.1016/j.jvolgeores.2013.03.011 URL [本文引用: 1]
The particulate methane monooxygenase gene pmoA and its use as a functional gene probe for methanotrophs
[J].The particulate methane monooxygenase gene pmoA, encoding the 27 kDa polypeptide of the membrane-bound particulate methane monooxygenase, was amplified by PCR from DNA isolated from a blanket peat bog and from enrichment cultures established, from the same environment, using methane as sole carbon and energy source. The resulting 525 bp PCR products were cloned and a representative number of clones were sequenced. Phylogenetic analysis of the derived amino acid sequences of the pmoA clones retrieved directly from environmental DNA samples revealed that they form a distinct cluster within representative PmoA sequences from type II methanotrophs and may originate from a novel group of acidophilic methanotrophs. The study also demonstrated the utility of the pmoA gene as a phylogenetic marker for identifying methanotroph-specific DNA sequences in the environment.
Application of geo-microbial prospecting method for finding oil and gas reservoirs
[J].
烃类微渗漏与宏渗漏的识别及镇巴长岭—龙王沟地区勘探实践
[J].
Identification of microseepage from macroseepage and exploration practice in Changling-Longwanggou area of Zhenba block
[J].
Syntrophic interactions within a butane-oxidizing bacterial consortium isolated from Puguang gas field in China
[J].
沉积有机质微生物降解与生物气源岩识别——以柴达木盆地三湖坳陷第四系为例
[J].
DOI:10.7623/syxb201603004
[本文引用: 1]

生物气的主要组分甲烷是不同微生物菌群协同降解复杂有机质的终端产物,研究生物气生成过程中微生物对沉积有机质降解的生物标志化合物特征,对柴达木盆地东部生物气气源层识别具有重要意义。柴达木盆地三湖坳陷涩北一号气区第四系沉积物饱和烃生物标志化合物的研究发现,一些泥岩层内饱和烃组分遭受微生物降解,使部分正构烷烃和无环类异戊二烯烷烃消失,色谱不可分辨的复杂有机混合物显著升高。微生物降解作用明显的泥岩,降解参数升高,可溶有机质含量与烃转化率也显著升高,反映第四系部分泥岩层中高的可溶有机质含量与烃含量,是微生物活动和降解原始沉积有机质的产物。在微生物降解作用明显的泥岩中,检测到了丰富的产甲烷菌特殊生物标志化合物2,6,10,15,19-五甲基二十烷等,表明降解程度高的泥岩中,不仅厌氧降解细菌活动强烈,产甲烷菌活动也很强烈,是生物气的优质烃源岩。因此可以得出:可溶有机质含量,特别是其中烃含量以及微生物降解参数,是评价生物气气源岩的重要依据。
Biodegradation of depositional organic matter and identification of bio-genic gas source rocks:An example from the Sanhu depression of Qaidam Basin
[J].
微生物地球化学勘探技术在准噶尔盆地的应用
[J].
Application of microbial geochemical exploration technologies in the Junggar Basin
[J].
Microbiota and their affiliation with physiochemical characteristics of different subsurface petroleum reservoirs
[J].
塔里木盆地新和地区低幅度构造油气微生物特征及有利目标区预测
[J].
Microbial characteristics of low-amplitude structures and prediction of favorable target areas in Xinhe area,Tarim Basin
,[J].
Practical innovations for high-throughput amplicon sequencing
[J].
DOI:10.1038/nmeth.2634
PMID:23995388
[本文引用: 1]

We describe improvements for sequencing 16S ribosomal RNA (rRNA) amplicons, a cornerstone technique in metagenomics. Through unique tagging of template molecules before PCR, amplicon sequences can be mapped to their original templates to correct amplification bias and sequencing error with software we provide. PCR clamps block amplification of contaminating sequences from a eukaryotic host, thereby substantially enriching microbial sequences without introducing bias.
The microbial activity in development of hydrocarbon microseepage:An indicator for oil and gas exploration
[J].DOI:10.1007/s12303-013-0026-y URL [本文引用: 1]
分子生物学技术在热泉地质微生物学研究中的应用
[J].
Molecular biological technologies applied in geo-microbiology of terrestrial geothermal environments
[J].
Molecular technologies for assessment of bioremediation and characterization of microbial communities at pollutant-contaminated sites[G]//Bioremediation of Industrial Waste for Environmental Safety
De novo semi-alignment of 16S rRNA gene sequences for deep phylogenetic characterization of next generation sequencing data
[J].
DOI:10.1264/jsme2.me12157
PMID:23603801
[本文引用: 1]

We addressed the challenges of analyzing next-generation 16S rRNA gene deep sequencing data from the uncharacterized microbial majority. This was performed using a novel de novo semi-alignment approach. The semi-alignments were based on Orthologous Tri-Nucleotides (OTNs), which are identical trinucleotides located in the same sequence region. OTNs in high error homopolymeric tracts were excluded to avoid overestimation of genetic distances. Phylogenetic information was derived assuming an exponential decay in shared OTNs between pairs of bacteria. OTN relatedness was also explored through principal component analysis (PCA). In evaluating the OTN approach we reanalyzed a dataset consisting of triplicate GS FLX titanium pyrosequencing runs for each of two experimental soil samples, in addition to analyses of the Greengenes core dataset. The conclusion from these comparisons was that the OTN approach was superior to traditional alignments both with respect to speed and accuracy. We therefore believe that our OTN-based semi-alignment approach will be a valuable contribution to future exploration of deep sequencing data.
Methanotrophic community detected by DNA-SIP at Bertioga's mangrove area,Southeast Brazil
[J].
DOI:10.1007/s00248-020-01659-7
PMID:33392629
[本文引用: 1]

Methanotrophic bacteria can use methane as sole carbon and energy source. Its importance in the environment is related to the mitigation of methane emissions from soil and water to the atmosphere. Brazilian mangroves are highly productive, have potential to methane production, and it is inferred that methanotrophic community is of great importance for this ecosystem. The scope of this study was to investigate the functional and taxonomic diversity of methanotrophic bacteria present in the anthropogenic impacted sediments from Bertioga´s mangrove (SP, Brazil). Sediment sample was cultivated with methane and the microbiota actively involved in methane oxidation was identified by DNA-based stable isotope probing (DNA-SIP) using methane as a labeled substrate. After 4 days (96 h) of incubation and consumption of 0.7 mmol of methane, the most active microorganisms were related to methanotrophs Methylomonas and Methylobacter as well as to methylotrophic Methylotenera, indicating a possible association of these bacterial groups within a methane-derived food chain in the Bertioga mangrove. The abundance of genera Methylomonas, able to couple methane oxidation to nitrate reduction, may indicate that under low dissolved oxygen tensions, some aerobic methanotrophs could shift to intraerobic methane oxidation to avoid oxygen starvation.
Development of a prmA genes quantification technique and assessment of the technique's application potential for oil and gas reservoir exploration
[J].
电感耦合等离子体发射光谱法测定地热水中的硫化物
[J].
Determination of sulfide in geothermal water by inductively coupled plasma-optical emission spectrometry
[J].
离子选择电极法测定水热气体中的硼含量及硼的气态迁移能力研究
[J].
Determination of boron content in hydrothermal vapor by ion selective electrode method:Insights into the gaseous transport of boron
[J].
电感耦合等离子体发射光谱法测定西藏日多温泉地热水中11种主次量元素
[J].
Determination of 11 major and minor elements in geothermal water of the riduo hotsprings from tibet by inductively coupled plasma-optical emission spectrometry
[J].
电感耦合等离子体质谱法测定高海拔地区地热水中的微量元素
[J].
Determination of trace elements in thermomineral waters of a high altitude area by inductively coupled plasma-mass spectrometry
[J].
地热田碱性蛋白酶菌株的选育与酶性质的研究
[J].
Breeding of alkaline protease producing strain from geothermal field and properties of the enzyme
[J].
Multitrophic interactions in a geothermal setting:Arthropod borings,actinomycetes,fungi and fungal-like microorganisms in a decomposing conifer wood from the Jurassic of Patagonia
[J].
中国温泉之乡巢湖市的地热资源及其开发利用
[J].
Geothermal resource and its development and utilization in Chaohu City,Hot Spring Land in China
[J].
巢湖地区构造应力场研究及动力分析
[J].
Study on the tectonic stress field and dynamic analysis of Chaohu area
[J].
郯庐断裂带皖东段与滁河断裂构造及地震活动相关性研究
[J].
Correlation of tectonics and seismicity in Tancheng-Lujiang fault zone in east Anhui and Chuhe fault
[J].
合肥温泉之乡半汤地热成因模式及其外围地热前景探讨
[J].
Genetic model of the geothermal energy in Bantang,a spa town in Hefei and the exploration potential in the periphery
[J].
安徽昭关温泉形成条件及地热水化学特征分析
[J].
Formation conditions and chemical characteristics of geothermal water in Zhaoguan,Anhui Province
[J].
基于高通量测序技术研究玉北油田上方微生物多样性
[J].
Microbial diversity in Yubei Oil field determined by high-throughput sequencing
[J].
基于高通量测序技术研究页岩气区上方微生物多样性
[J].
Microbial diversity above a shale gas field using high-throughput sequencing
[J].
气相色谱法测定油气化探样品中酸解烃的研究
[J].
Determination of acidolysis hydrocarbons in oil/gas geochemical exploration samples by gas chromatography
[J].
顶空气分析技术在井中化探中的应用研究
[J].
Top gas analysis technique applied to well geochemical exploration
[J].
地表土壤碳酸盐热解与碳同位素实验研究
[J].
Pyrolysis and c-isotopic study on carbonates of surface soil
[J].
模拟气碳同位素在线分析技术
[J].
On-line analytical technology of carbon isotopes for simulated gases
[J].
腾冲新生代火山区温泉CO2气体排放通量研究
[J].
CO2 flux estimations of hot springs in the Tengchong Cenozoic volcanic field,Yunnan Province,SW China
[J].
地质微生物学中几项最新研究进展
[J].
Recent developments in geomicrobiology
[J].
Temperature governs the distribution of hot spring microbial community in three hydrothermal fields,Eastern Tibetan Plateau Geothermal Belt,Western China
[J].DOI:10.1016/j.scitotenv.2020.137574 URL [本文引用: 1]